El átomo es el elemento más pequeño de cualquier materia que retiene su identidad como elemento químico. El nombre proviene de la palabra griega que significa “indivisible”, y se ha seguido empleando esta palabra pese a que ahora sabemos que el átomo está compuesto de partículas aun más pequeñas.
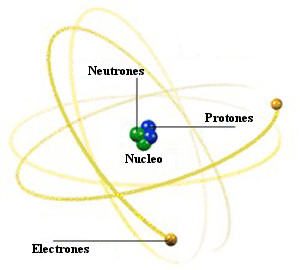
Los electrones tienen cargas negativas, los protones positivas y los neutrones no poseen carga eléctrica.
La moderna teoría sobre el átomo se originó gracias al químico y matemático británico John Dalton, que publicó en 1808 un libro titulado “Nuevo sistema de filosofía química”. En dicha publicación, Dalton propuso algo muy parecido a nuestra moderna teoría. Analizó que para cada elemento químico hay un tipo diferente de átomo, y que distintos materiales (lo que hoy denominaríamos compuestos químicos) son simplemente combinaciones diferentes de esos átomos.
El primer patrón sobre la estructura del átomo fue formulado en el año 1913 por Niels Bohr, un joven físico danés. El modelo se conoce actualmente en física como el modelo atómico de Bohr. La característica central del átomo de Bohr es que los electrones pueden encontrarse solamente en órbitas a ciertas distancias bien determinadas del núcleo. Las órbitas a esas distancias adoptaron el nombre de “órbitas permitidas” u “órbitas de Bohr”.

Niels Bohr (1885-1962)
Se requiere energía para que los electrones puedan moverse de una órbita más baja a una más alta, ya que es preciso realizar un trabajo para superar la fuerza de atracción que ejerce el núcleo sobre el electrón. De esta forma, es preciso añadir energía al átomo para mover el electrón en dicha dirección. De manera inversa, si un electrón se desplaza de una órbita superior a otra más baja, existe un exceso de energía de la que es preciso disponer.
Podemos comprobar que distintos átomos tienen diferentes órbitas de Bohr, ya que la energía de un electrón depende de las fuerzas que se ejerzan sobre él por el núcleo y por los otros electrones, y ambos cambian de un elemento al siguiente.
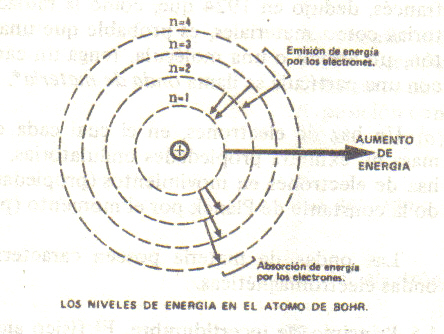
La emisión de luz se produce debido a una transición de una órbita de Bohr más alta a otra más baja. Si por alguna causa un electrón se encuentra en una órbita más alta, puede saltar de manera espontánea a otra más baja. Cuando realiza dicha acción, la diferencia de energía entre las órbitas inicial y final deja al átomo en la forma de un fotón. Éste es el proceso por el cual un átomo puede emitir luz y otras formas de radiación electromagnética.
Si un átomo absorbe luz, los electrones se moverán de órbitas Bohr inferiores a otras superiores. La energía de un fotón puede ser atraída por el átomo y empleada para desplazar el electrón de una órbita inferior a otra superior.
El que existan órbitas de Bohr demuestra que distintos átomos emiten colores diferentes de luz. Si un electrón se desplaza de una órbita a otra, deberá absorber o emitir solamente una cantidad específica de energía.
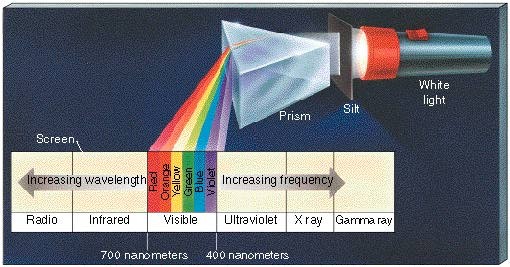
Al mismo tiempo, esto representa que cualquier átomo tiene la capacidad de emitir y absorber sólo esas mismas y discretas cantidades de energía. Ya que la energía de un fotón se encuentra relacionada con la longitud de onda, y en consecuencia vinculada con el color, de su luz, cada átomo puede emitir y absorber sólo ciertos colores. Debido a esto, las luces de neón son rojas y las lámparas de vapor de sodio amarillas.
Los átomos absorben lo mismo que emiten. La luz que absorbe un átomo corresponde al movimiento de un electrón hacia una órbita superior entre dos órbitas, mientras que el desplazamiento de un electrón desde una órbita superior a una órbita inferior producirá la emisión de esa longitud de onda de luz.
Debido a que la diferencia de energía entre las órbitas no obedece a la dirección del salto cuántico, de esto se puede concluir que si un átomo puede emitir un cierto color, también tendrá la capacidad de absorberlo.
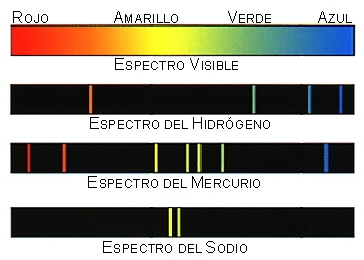
Los colores que emite un átomo son una especie de “huella dactilar atómica”, ya que no existen dos elementos que tengan de manera exacta idénticas órbitas de Bohr. Este hecho constituye los cimientos del campo de la ciencia que se conoce como espectroscopia.

El que un átomo pueda emitir y absorber un conjunto diferente de colores nos posibilita reconocer la presencia de ese átomo en pequeñas muestras de material. Abajo muestro un esquema del tipo de instrumento que puede emplearse para analizar la luz de una muestra.

Los distintos colores de luz que emite una muestra son desplegados por un prisma que nos procura la “huella dactilar” de dicha muestra en una placa fotográfica o generalmente en un detector electrónico. A este instrumento se le denomina espectrómetro. Esa huella dactilar es diferente para cada átomo y molécula.
La espectroscopia es de gran ayuda en el campo de la astronomía. A principios del siglo XIX, Auguste Comte (1798-1857), el promotor de la moderna sociología, hizo pública una lista de cosas que dijo que sería imposible llegar a realizar nunca. Entre las primeras de dicha lista figuraba el análisis de la composición química de las estrellas.
Pero el progreso de la espectroscopia en el siglo XIX permitió al ser humano hacer precisamente eso. Analizando la luz que emiten las estrellas, podemos estudiar las huellas dactilares atómicas de los átomos presentes, aunque la estrella se encuentre a millones de años luz de distancia y nunca podamos poner nuestras manos sobre un trozo de ella.
Los físicos modernos han adoptado una extraña imagen del átomo. Ya que piensan en las partículas cuánticas como el electrón en términos de funciones ondulatorias en vez de partículas clásicas, entienden los electrones como nubes indefinidas que envuelven al núcleo antes que como elementos semejantes a planetas rodeando el Sol. Los sitios donde las nubes sean más densas son donde probablemente se encuentre el electrón.