La química es la rama de la ciencia que se ocupa de la formación y propiedades de las moléculas, que son combinaciones de dos o más átomos. La química es la ciencia central. Toca casi todo lo demás: estudia las interacciones químicas en las estrellas, en los minerales, en las células y en las moléculas de los sistemas vivos, sólo por mencionar unos cuantos ejemplos.

Cuando los átomos se juntan, algunas reacciones liberan energía, mientras que otras requieren energía para realizarse. Por ejemplo, cuando el oxígeno se combina con el carbono en un fuego de leña, se libera calor. Por otra parte, no podemos hornear un pastel a menos que pongamos energía en forma de calor dentro de la masa. Si la reacción libera energía, decimos que es exotérmica, mientras que si requiere energía decimos que es endotérmica.

Casi todos los materiales que encontramos en la vida cotidiana están formados por una combinación de átomos, antes que por átomos aislados. Incluso el aire que respiramos está formado primariamente por moléculas de oxígeno y nitrógeno (cada uno de ellos formado por dos átomos unidos). Las ropas que llevamos, la comida que comemos, incluso nuestro cuerpo, todo está hecho de moléculas.
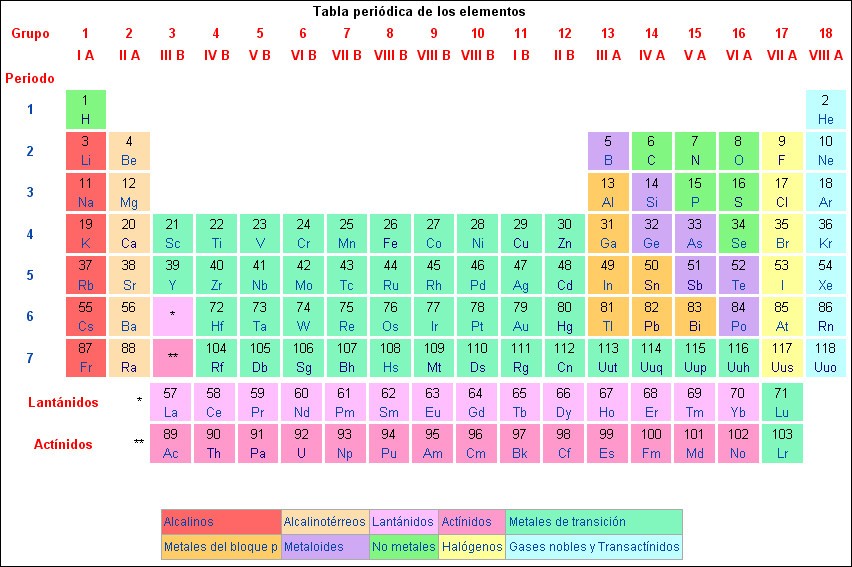
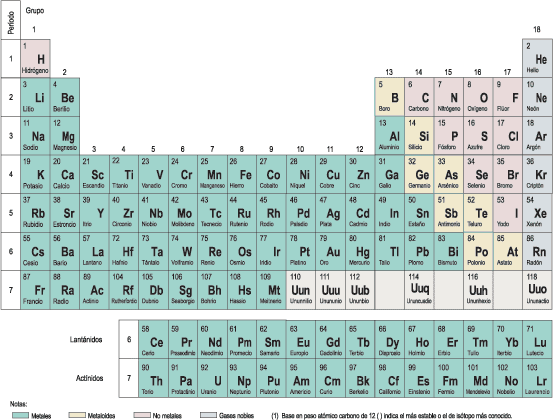
Todas las moléculas están formadas a partir poco más de 100 elementos químicos. Cuando la química inició su andadura en su forma moderna en el siglo XVIII, los químicos aprendieron rápidamente que podían descomponer los materiales ordinarios. Una compleja estructura como la madera podía ser quemada para producir carbono (en forma de carbón) y diversos gases. Cuando los químicos llevaron a cabo ese tipo de operaciones, descubrieron que había una unidad fundamental más allá de la cual la materia no podía ser descompuesta por técnicas a su disposición en aquella época. Llamaron a esos constituyentes «irreductibles» de la materia elementos. Hoy en día el registro de esos elementos químicos excede de los cien.
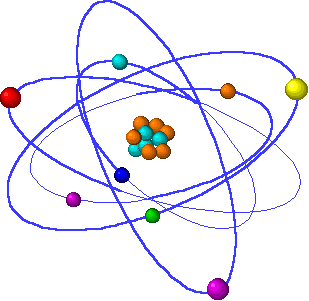
Cada elemento químico corresponde a un tipo diferente de átomo. Los distintos elementos químicos tienen un número diferente de protones en su núcleo y un número diferente de electrones en órbita. Así, un átomo corresponde al elemento carbono si tiene seis protones en su núcleo y seis electrones en órbita, mientras que corresponde al elemento oxígeno si tiene ocho de cada.
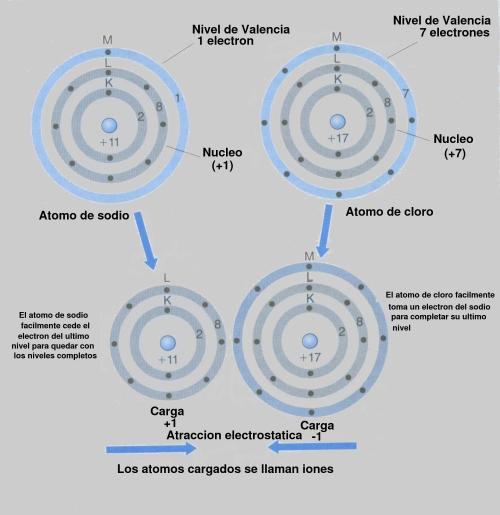
La propensión de un átomo a interactuar con sus compañeros depende de la forma en que están dispuestos los electrones. Cuando dos átomos se sitúan cerca el uno del otro, cada cual ve primero los electrones más externos del otro. El que los dos átomos se unan o sigan sus caminos separados depende de la forma en que estén dispuestos esos electrones. Así, son los electrones exteriores lo que determinan si el átomo tomará parte en reacciones químicas.
Los electrones más externos de un átomo reciben el nombre de electrones de valencia. Otra forma de expresar esta idea, pues, es decir que las propiedades químicas de un átomo dependen de sus electrones de valencia.
Los elementos más pesados que el uranio están elaborados en laboratorios por científicos que tratan de crearlos específicamente. Tienden a ser radiactivos, y a tener vidas medias cortas. La mayor parte de la última hilera de la tabla periódica fue creada artificialmente. La técnica básica para elaborar nuevos elementos es poner un núcleo en un acelerador, aumentar su velocidad, y dejar que colisione con otro.
En la reacción resultante, los dos núcleos se fusionan ocasionalmente para formar uno más pesado, que, cabe esperar, pueden ser identificados antes de que se desintegren.
Los elementos químicos han recibido sus nombres por una variedad de razones. Por ejemplo, el hidrógeno lleva su nombre debido a que es el generador del agua. Es una suerte desde el punto de vista de la estética que el equivalente alemán de esta palabra, Wasserstoffl fuese vencido por su equivalente griego.

Otros elementos han sido nombrados por el color de la luz que emiten: cesio, por ejemplo, significa “azul cielo”. Más recientemente, los elementos químicos han recibido su nombre para honrar a famosos científicos (einsteinio y mendelevio) y lugares (berkelio, por Berkeley, California, donde fue descubierto este elemento en particular).
En 1982, un grupo de Darmsstadt, Alemania, consiguió crear un átomo del elemento 106, el seaborgio. Fue uno de los elementos más pesados jamás visto, aunque posteriormente fue superado por el Ununhexio o el Ununoctio.




Menuda clase magistral macho. Le pasare el enlace a mis hijas dentro de unos años, jajaja. Recuerdo que al principio me parecía un coñazo, pero si pasas esta fase puede llegar a ser fascinante y ayuda a entender muchisimas cosas.
Saludos.
quiero saber una formula de acidos para brillar acero inoxidable le agradesco a la persona que me quiera ayudar