La manera en que se comporta cualquier clase de materia, depende de la forma que se unen entre sí los átomos de esa materia. Cada propiedad de la materia está relacionada con los átomos. Algunos ejemplos:
Presión – Cuando hinchamos un globo, bombardeamos montones de moléculas de aire en su interior. Esas moléculas van de un lado para otro dentro del globo y, cuando golpean su pared, rebotan. Cada rebote ejerce una diminuta fuerza en el globo, y la presión que podemos leer en un indicador de presión es sólo la suma total de todas esas fuerzas.

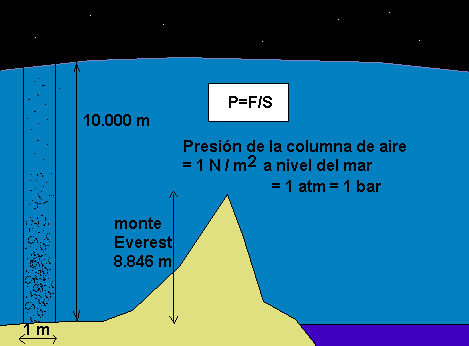
Presión del aire y el agua – Tanto el aire como el agua están hechos de moléculas, y ambos son en consecuencia capaces de ejercer una presión. Las moléculas en un cubo de agua en medio del océano, por ejemplo, ejercerán una presión contra todos los lados del cubo: arriba, abajo y hacia los lados.

Si imaginamos una columna de agua que se extiende hacia abajo en el océano, la fuerza de la gravedad hacia abajo sobre esa columna tiene que ser equilibrada por la fuerza hacia arriba ejercida por el agua debajo de ella. Así, cuanto más bajemos en el océano (o en la atmósfera), mayor será la presión. Al nivel del mar, por ejemplo, el aire ejerce una presión de 1 kilo por cm2.
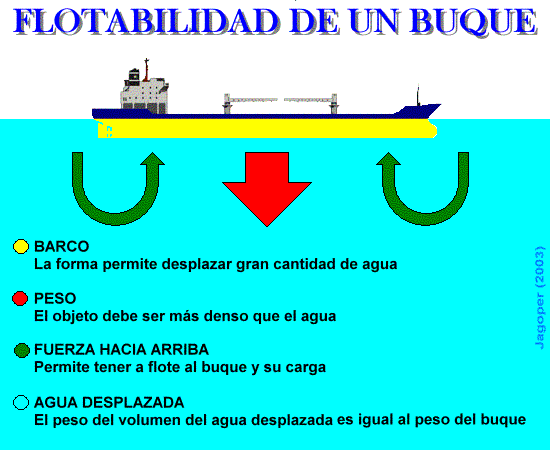
Flotabilidad – Si metemos algo en el agua, se ejercerá una presión sobre ello. El resultado de esta presión es una fuerza hacia arriba a la que llamamos flotabilidad. Esta fuerza es igual al peso del agua desplazada por el objeto, de modo que si el objeto es menos denso que el agua, flotará. De otro modo, se hundirá.
Podemos pensar por ejemplo, que cómo un transatlántico puede flotar si el hierro es más pesado que el agua. Pues debemos pensar que la cantidad de agua desplazada por el barco, es igual al volumen de hierro más el aire dentro del casco. Si el barco estuviera lleno de agua (o de hierro), se hundiría.
Adhesión y cohesión – Cuando las moléculas de algún material son atraídas a otras moléculas del mismo material, denominamos a esa fuerza cohesión. Es la fuerza que conserva las cosas de una pieza. Si las moléculas de diversas materias son atraídas unas a otras, la fuerza entonces se denomina cohesión. Dicha fuerza, permite que una cosa se pegue a otra. En los dos casos, sin embargo, la base para la fuerza es la atracción entre átomos.

Adhesión y cohesión
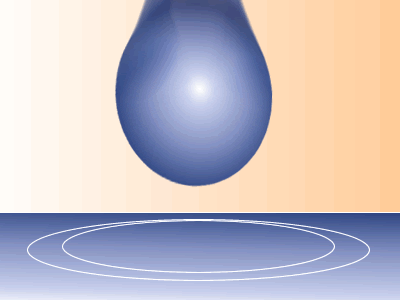
Tensión superficial – Las fuerzas cohesivas dentro de un líquido tienden a hacer que el líquido adopte forma esférica. Cuando una gota de agua “forma una cuenta” sobre un impermeable, es la fuerza de cohesión la que la mantiene así. Los físicos piensan en los efectos de la cohesión como en una fuerza que mantiene la superficie unida, y llaman a esa fuerza tensión superficial.

Elasticidad – Es la propiedad de los sólidos que les hace volver a su forma original cuando han sido deformados. Cuando doblamos una pieza de metal, sus átomos ejercen una fuerza que se opone al doblado. Tan pronto como la soltamos, las fuerzas interiores actúan y el metal vuelve a su posición original.


Compresibilidad – Puesto que las fuerzas entre los átomos pueden volverse repulsivas si los átomos son apretados demasiado juntos, los materiales se resisten a las fuerzas exteriores que intentan comprimirlos. Algunos materiales, como el acero y el agua, se resisten muy fuertemente. Otros, como el aire, no.
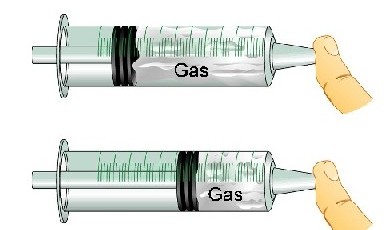
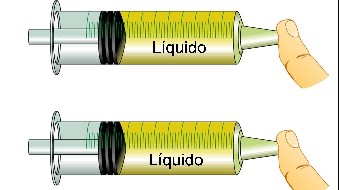
Fuerza tensora – Del mismo modo que los materiales se resisten a que sus átomos sean comprimidos juntos, se resisten también a que sean separados. La fuerza tensora mide la fuerza requerida para superar las fuerzas de atracción entre átomos y separarlos. El acero tiene también una alta fuerza tensora: resulta difícil separar sus átomos, aunque sea fácil romperlo.

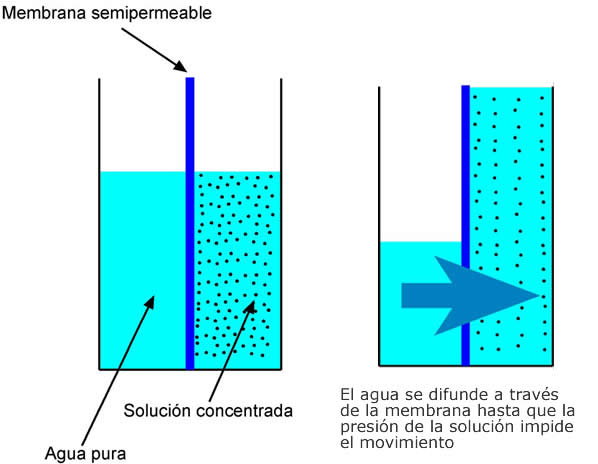
Ósmosis – Si dos soluciones son separadas por una membrana, el agua (pero no las moléculas en solución) puede moverse a través de la membrana, cambiando la concentración de la solución de ambos lados. Esto recibe el nombre de ósmosis. Cuando la piel presenta un aspecto arrugado después de estar en la bañera demasiado tiempo, es porque el agua ha fluido dentro de nuestras células por ósmosis.

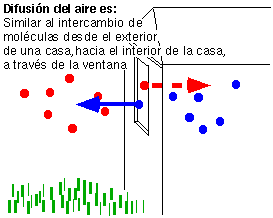
Difusión – Cuando las moléculas de dos fluidos distintos se unen al movimiento molecular normal, da como resultado que dos conjuntos de moléculas se entremezclen. Este proceso recibe el nombre de difusión. Si dejamos caer una gota de tinta en un vaso de agua, podemos seguir el rastro de la difusión a medida que la tinta se expande.
Puesto que la difusión depende sólo del movimiento de las moléculas, puede aparecer en lugares inesperados. Es bien sabido de los ingenieros, por ejemplo, que los gases pueden difundirse en (e incluso a través de) contenedores metálicos. Los científicos espaciales tienen que preocuparse por los gases que se difunden a través de las pareces de la nave espacial en las misiones largas.
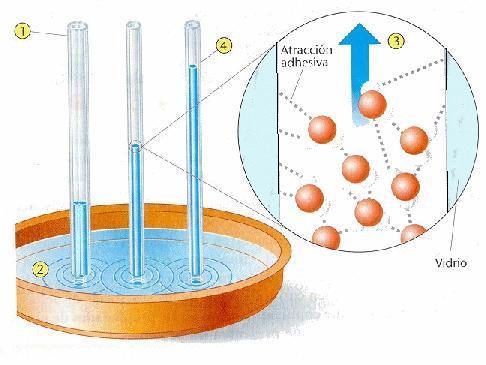
Capilaridad – Si metemos un tubo delgado hueco en un líquido, el líquido ascenderá dentro del tubo con respecto al nivel exterior. Este efecto recibe el nombre de capilaridad. Funciona de esta forma: el empuje hacia abajo de la gravedad sobre el líquido en el tubo es superado por la fuerza de adhesión entre el líquido y las pareces del tubo.
Es la capilaridad la que alza el agua en las plantas (otro mecanismo que hace que entre el agua por las raíces es la ósmosis, pero lo que verdaderamente hace que suba el agua hacia las copas de los arboles (hasta 20-30 metros de altura), es la pérdida constante de agua que estos sufren por las hojas debido a la transpiración, creándose una presión negativa que se compensa con la entrada de agua nueva por las raíces).
Para un tubo de un tamaño determinado, hay un límite a lo alto que puede ascender un líquido. El peso de la columna líquida no puede exceder a la fuerza de ascensión ejercida por la cohesión.




Muy completo. Gracias
ME HIZO DE GRAN AYUDA, GRACIAS
gracias me sirvio mucho…gracias de nuevo :)
muy buena informacion… gracias..!!!!
muchas gracias,
me ha servido mucho tios
:)grxias
Bue Bue muxisimas gracias me sirvio demaselco se los agradesco x la info XD :) :D ;)8):8 :p xp
me sirvio de mucha ayuda
gracias :)
gracias me libro de una reprobada
me sirvio demasiado
si que me va a servir para el examen trimestral
aunque estoy bien en la materia
me ayudo mucho gracias espero que sigan asi
Muchas gracias px la ayuda….
muy buena la informacion para el primer semstre de quimica..!!
gracias me sirvio de mucho
Muy bna su informacion… y geniales las imagenes… (Y)
gracias por la informacion era justo lo que andava buscando, mil gracias
gracias me sirvio de mucho .Muy bna su informacion
grasias me sirvio mucho
me sirbio muchísimo ¡chevere!
bn…me sirvio..espero q te sirva tambien…ok.:)
muchas gracias me sirvio para mi tarea jaja xS
muchas gracias me sirvio mucho
hola ami tambien me sirvio para mi tarea de ciencias naturales grax
XD :d
muy bueno me sirvió muchísimo grasias :)
muy bueno :)
jejej gracias por esta info me saque una buena nota en c.naturales
gracias me sirvio de mucho hee gracias, gracias…..
gracias por esta informacion si k m sirvio espero y me sak’ un 10 la maestra
gracias me sirvió de mucho me encanto esta investigación
graciias me ha servido de mucho tio creo ke es un gran articulo pero la verdad gracias tio
Gracias me sirvió , fue de mucha ayuda la información
lo maximo fue de demasiada ayuda
muy buena la info y tmb las imagenes
muy bien me gusto